Theo các nhà khoa học, bệnh viêm quanh răng được khởi phát và tiến triển bởi một nhóm vi khuẩn kị khí, gram âm khu trú trong vùng dưới nướu.
Hội nghị quốc tế về lâm sàng bệnh quanh răng năm 1996 đã kết luận: nguyên nhân chính của bệnh viêm quanh răng ở người là do Porphyromonas gingivalis, Bacteroides forsythus và Acinobacillus actinomycetemcomitans gây ra. Trong số đó, Porphyromonas gingivalis được coi là một trong nhưng tác nhân quan trọng nhất gây bệnh viêm quanh răng.
Gingipains – vai trò trong cơ chế bệnh sinh của viêm quanh răng (1,2,3)
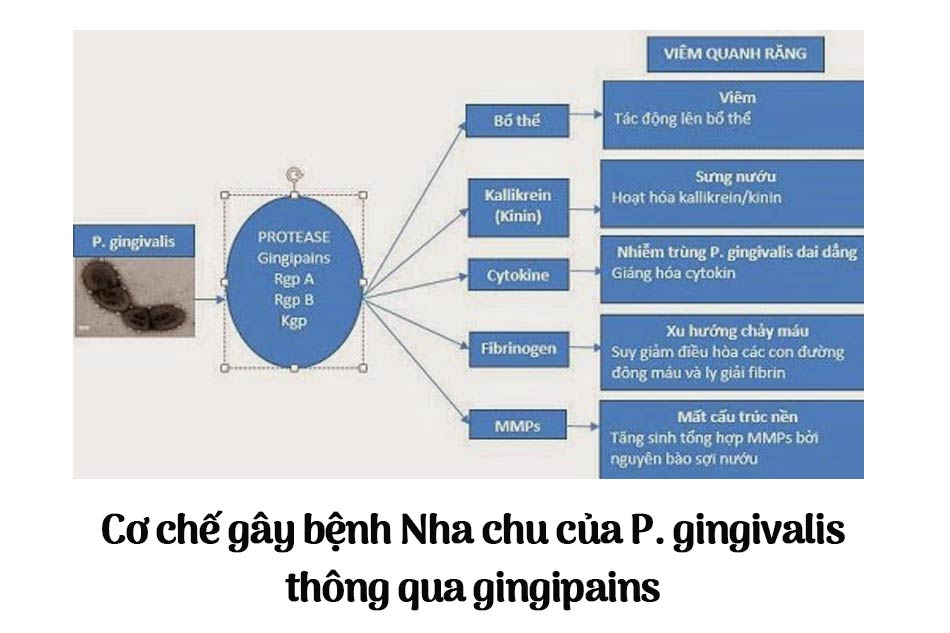
P.gingivalis gây bệnh bằng cách sản xuất ra các độc tố như các polysaccharide, fimriae, hemaglutinin, chất gây tan huyết và các men phân hủy protein. Arg- và Lys-cystein protease (còn gọi là gingipains ) là những men phân hủy peptid quan trọng nhất do P.gingivalis tạo ra. Trong số các yếu tố gây bệnh của P.gingivalis , Gingipains đóng vai trò then chốt trong quá trình tiến triển của bệnh viêm quanh răng ở người, đặc biệt làm tăng tích tụ vi khuẩn, ức chế đáp ứng bảo vệ của cơ thể, phá hủy mô và làm thay đổi hệ thống miễn dịch của cơ thể. Gingipains có khả năng phân hủy các protein của cơ thể như protein gian bào, các tế bào miễn dịch và cytokine, phân hủy fibrin và fibrinogen dẫn tới tình trạng chảy máu nướu, gây phá hủy mô quanh răng. Gingipains còn giúp P.gingivalis xâm nhập sâu vào mô quanh răng và ngấm vào máu gây các biến chứng toàn thân.
P.gingivalis là chủng không có hoạt tính ly giải saccharide mà lấy năng lượng và carbon từ việc len men các peptid và acid amin. Điều đó có nghĩa là để xâm nhập được vào vật chủ, vi khuẩn này cần phải cạnh tranh và khai thác các peptides sẵn có để tăng trưởng hoặc giáng hóa các protein của vật chủ để lấy peptides. Với hoạt tính phân hủy protein rất mạnh của các gingipains trong môi trường giàu protein ở khoang miệng chính là các điều kiện thận nướu cho sự sống còn của vi khuẩn này so với các vi khuẩn khác.
Họ gia đình gingipains gồm 3 men protease liên quan tới cysteine có tác dụng thủy phân các chuỗi peptid tại vị trí các nhóm carbonyl của Arginine (Arg-Xaa) và tận cùng Lysine (Lys-Xaa). Các gingipains đặc hiệu Arginine giống nhau là RgpA và RgpB là sản phẩm của 2 gen có liên quan là RgpA và RgpB trong khi đó gingipain đặc hiệu lysine, Lys-gingipain (Kgp) được mã hóa bởi gen Kgp. RgpB được giải phóng vào quanh bào tương như là một protein gồm 2 vùng tận cùng N (NPD), một vùng protease và 1 vùng tận cùng C (CTD). Ngược lại với RgpB, RgpA và Kgp có vùng bám dính (ngưng kết hồng cầu /adhension-HA) xen vào giữa vùng protease và CTD.
Trong bào tương hoặc trong quá trình di chuyển ra màng ngoài tế bào, gingipains cũng bị thủy phân. NPD và CTD bị cắt trong khi vùng HA trên RgpA và Kgp được phân mảnh thành các tiểu vùng. Các vùng nhỏ nỳ sau đó được gắn với vùng protease qua tương tác không cộng trị. Gingipains trưởng thành được giải phóng dạng hòa tan hoặc được glycosyl hóa với anion LPS cho phép chúng hiện diện ở màng ngoài.
Trên bề mặt màng tế bào vi khuẩn RgpA và Kgp tạo thành phức hợp đa chức năng gồm thủy phân protein, thu nạp Hem, hoạt hóa tiểu cầu, kết dính hồng cầu, gây tan máu, bám dính vào chất nền ngoài tế bào. Chính vì vậy khả năng gây bệnh của P.gingivalis bị giảm sút trầm trọng ở các chủng có đột biến ginigapin khi gây nhiễm trên động vật thực nghiệm. Các nghiên cứu cho thấy gingipain là một đích tác dụng tiềm năng cho sự phát triển các chất ức chế có thể sử dụng trong điều trị viêm quanh răng.
Ức chế Gingipains – Giải pháp mới trong việc hỗ trợ điều trị bệnh viêm quanh răng
Với vai trò then chốt và quan trọng trong sinh lý bệnh viêm quanh răng của gingipains, các nhà khoa học cho rằng việc ức chế các gingipains có thể một đích điều trị bệnh.
Người ta cho rằng việc ức chế hoạt tính của gingipain trên vivo có thể ngăn ngừa hoặc làm chậm tiến triển của bệnh viêm quanh răng ở người lớn. Cho tới nay đã có hàng loạt các chất ức chế men gingipains được xác định, gồm các chất ức chế vùng tận cùng N của gingipain, các hợp chất tổng hợp, các chất úc chế có nguồn gốc tự nhiên, kháng sinh, sát khuẩn, kháng thể và vi khuẩn(4).
Các kháng sinh có thể tác động tới đích protease của vi khuẩn (5). Dẫn xuất benzamindine ức chế hoạt tính của RgpA và RgpB (6, 7). Trong số các dẫn xuất benzamindine, bis-benzamidine có tác dụng ức chế gingipains tiềm năng nhất. Kết hợp với kẽm ở nồng độ thấp, tác dụng ức chế gingipains của benzamidine tăng gấp 2-3 lần. Chlorhexidine, tetracyclin và các dẫn xuất của tetracycline đều có tác dụng ức chê sgingipains và hiệu quả tăng lên khi kết hợp với kẽm (8-11). Chlorhexidine, cetylpyridium chloride, minocycline và doxycycline đều có có tác dụng ức chế một phần sự giáng hóa collagen gây ra bởi Rgp trong khi đó Metronidazole không có tác dụng này (12). Tetracyclin ở nồng độ 100µ ức chế hoàn toàn hoạt tính ly giải amin của RgpA và RgpB. Điều này giúp giải thích một phần hiệu quả điều trị của tetracyclin trong điều trị viêm quanh răng.
Nhiều hợp chất tổng hợp là các chất ức chế gingipain tiềm năng nhưng cũng có tác dụng ức chế men protease của người dẫn tới các tác dụng không mong muốn. Các hợp chất tổng hợp cũng không được biết rõ về độc tính, nên hiện vẫn chưa có nghiên cứu lâm sàng nào được thực hiên. Ngược lại, với độ an toàn cao, các chất ức chế gingipain từ tự nhiên được coi là một liệu pháp điều trị viêm quanh răng hứa hẹn, gồm:
- Polyphenol chiết xuất từ trà xanh
Các polyphenol (catechins) chiết xuất từ trà xanh được cho là có tác dụng chống oxy hóa, kháng viêm, chống ung thư và kháng khuẩn. Đối với bệnh quanh răng, các nghiên cứu lâm sàng cho thấy sử dụng catechins tại chỗ mang lại sự cải thiện ý nghĩa các chỉ số lâm sàng như chỉ số viêm nướu, độ sâu túi nướu, mất bám dính và chỉ số mảng bám so với điều trị cơ học đơn thuần (13-16). Sự cải thiện tình trạng quanh răng tại các vị trí sử dụng trực tiếp catechins là do tác dụng ức chế protease (17-18) và ức chế giải phóng các cytokine tiền viêm và chemokine từ các tế bào biểu mô và nguyên bào sợi /miệng (16-20). Catechins cũng ức chế trực tiếp gingipains và góp phần mang lại hiệu quả điều trị của dịch chiết trà xanh. Tiềm năng ức chế gingipains cùng với tác dụng can thiệp vào sự tăng trưởng của P.gingivalis cũng như ức chế phản ứng viêm khiến cho các hợp chất này có thể là những” ứng cử viên” để phát triển các sản phẩm điều trị cho bệnh viêm quanh răng và các bệnh toàn thân liên quan như xơ vữa động mạch (21).
- Polyphenol chiết xuất từ cranberry hoặc từ các loại ngũ cốc như gạo
- Kháng thể IgY (Yolk immunoglobulin – kháng thể từ lòng đỏ trứng) và vaccin
Liệu pháp vaccin sử dụng kháng nguyên là gingipain
Genco và cộng sự (1998) cho thấy gây miễn dịch cho chuột bằng đoạn peptid gồm các acid amin của vùng có tác dụng xúc tác của gingipains R mang lại tác dụng bảo vệ chuột khỏi sự xâm nhập của P.gingivalis
Gibson và cs (2001) cũng cho thấy gây miễn dịch với RgpA kích thích sản xuất kháng thể đặc hiệu với vùng hemaglutinin, góp phần ngăn ngừa mất xương ở răng gây ra bởi P.gingivalis .
Tuy nhiên một đánh giá tổng quan về các nghiên cứu tiền lâm sàng cho thấy do số lượng và chất lượng không đủ trong các nghiên cứu trên động vật, hiện vẫn chưa có đủ bằng chứng về bất cứ hiệu quả nào của miễn dịch chủ động chống lại các tác nhân gây viêm quanh răng (22).
Nếu sử dụng vaccine có kháng nguyên là gingipain được gọi là miễn dịch chủ động thì việc sử dụng kháng thể IgY trực tiếp chống lại men gingipain được bổ sung tại chỗ vào khoang miệng là liệu pháp miễn dịch thụ động. Kháng thể IgY thu được bằng cách: sử dụng gingipain làm kháng nguyên gây miễn dịch cho gà mái, kháng thể đặc hiệu chống gingipain được sản xuất và tích lũy trong lòng đỏ trứng gà, sau đó được tách chiết và làm tinh khiết.
Một thử nghiệm lâm sàng sử dụng kháng thể từ lòng đỏ trứng chống lại gingipain (IgY-PG) trên 5 bệnh nhân bị viêm quanh răng mạn tính và có nồng độ P.gingivalis cao trong vùng dưới nướu (23). Dạng kem chứa IgY-PG được đưa trực tiếp vào túi nướu. Trước khi sử dụng IgY-PG, người ta làm sạch mảng bám và túi nướu trên bề mặt răng được thử. Nồng độ P.gingivalis trong các túi chân răng của tất cả các răng điều trị được biểu đạt bằng tỷ lệ % /tổng vi khuẩn xác định bằng PCR. Việc kết hợp giữa làm sạch mảng bám và túi chân răng với IgY-PG đã làm giảm được độ sâu của túi chân răng, chảy máu trong túi chân răng và nồng độ P.gingivalis tại thời điểm 4 tuần so với làm sach mảng bám và túi chân răng đơn thuần.
Một nghiên cứu khác đánh giá hiệu quả của IgY-PG trên 42 bệnh nhân viêm quanh răng sau khi làm sạch mảng bám và túi chân răng theo phương pháp lựa chọn ngẫn nhiên có nhóm đối chứng (24). Chia ngẫu nhiên các bệnh nhân chưa được điều trị viêm nha chu vào 2 nhóm sử dụng làm sạch mảng bám, túi chân răng và dung viên ngậm IgY-PG hoặc đối chứng. Các chỉ số lâm sàng được ghi nhận tại thời điểm bắt đầu nghiên cứu, sau 4 tuần và 12 tuần điều trị. Lựa chọn các túi chân răng sâu nhất và các mẫu được thu thập để đánh giá nồng độ vi khuẩn P.gingivalis bằng PCR. Có sự cải thiện ý nghĩa về độ sâu trung bình của túi chân răng ghi nhận ở nhóm dùng IgY-PG sau 12 tuần điều trị. Cùng với những thay đổi về lâm sàng, số lượng vi khuẩn P.gingivalis trong các mảng bám dưới nướu từ các túi sâu nhất cũng giảm đáng kể ở nhóm dùng IgY-PG.
Các kết quả nghiên cứu cho thấy sử dụng IgY-PG hàng ngày kết hợp với làm sạch mảng bám và túi chân răng ở các bệnh nhân viêm quanh răng mang lại kết quả lâm sàng tốt hơn đáng kể cũng như giảm số lượng vi khuẩn so với nhóm đối chứng. Do vậy, miễn dịch thụ động sử dụng IgY-PG có thể là một phưong pháp hiệu quả trong điều trị viêm nha chu.
Mặc dù một chất ức chế gingipains lý tưởng chưa được xác định nhưng ức chế gingipains đại diện cho một xu hướng mới trong điều trị và ngăn ngừa bệnh viêm quanh răng. Các yếu tố ức chế gingipains cũng có thể giúp điều trị một số rối loạn toàn thân liên quan tới viêm quanh răng như bệnh tim mạch, viêm khớp dạng thấp, viêm phổi, sinh non và sinh nhẹ cân.
Tài liệu tham khảo:
- The role of Gingipains in the pathogenesis of Periodontal disease. Takahisa Imamura et al. Journal of Periodontology.Jan 2003, Vol.74, No.1: 111-118.
- The lysine-specific gingipain of Porphyromonas gingivalis: importance to pathogenicity and potential strategies for inhibition. Yongqing T et al. Adv Exp Med Biol.2011;712:15-29
- The gingipains: scissors and glue of the periodontal pathogen, Porphyromonas gingivalis. Future Microbiol.2009 May; 4(4):471-87.
- Strategies for the inhibition of gingipains for the potential treatment of periodontitis and associated systemic diseases.Ingar Olsen et al. Journal of Oral Microbiology.18 August 2014.
- Travis J, Potempa J. Bacterial proteinases as targets for the development of second-generation antibiotics. Biochim Biophys Acta 2000; 1477: 35 _ 50.
- Krauser JA, Potempa J, Travis J, Powers JC. Inhibition of arginine gingipains (RgpB and HRgpA) with benzamidin inhibitors: zinc increases inhibitory potency. Biol Chem 2002; 383: 1193 _ 8.
- Eick S, Pfister W, Stu¨ rzebecher U, Jarema S, Stu¨ rzebecher J.Inhibitors of benzamidine type influence the virulence properties of Porphyromonas gingivalis strains. Acta Biochim Pol 2003; 50: 725 _ 34.
- Imamura T, Matsushita K, Travis J, Potempa J. Inhibition of trypsin-like cysteine proteinases (gingipains) from Porphyromonas gingivalis by tetracycline and its analogues. Antimicrob Agents Chemother 2001; 45: 2871 _ 6.
- Grenier D, Plamondon P, Sorsa T, Lee H-M, McNamara T, Ramamurthy NS, et al. Inhibition of proteolytic, serpinolytic, and progelatinase-b activation activities of periodontopathogens by doxycycline and the non-antimicrobial chemicallymodified tetracycline derivatives. J Periodontol 2002; 73: 79 _ 85.
- Genco CA, Odusanya BM, Potempa J, Mikolajczyk-Pawlinska J, Travis J. A peptide domain on gingipain R which confersimmunity against Porphyromonas gingivalis. Infect Immun 1998; 66: 4108_14.
- Sela MN, Babitski E, Steinberg D, Kohavi D, Rosen G. Degradation of collagen-guided tissue regeneration membranes by proteolytic enzymes of Porphyromonas gingivalis and its inhibition by antibacterial agents. Clin Oral Impl Res 2009; 20.
- Hirasawa M, Takada K, Makimura M, Otake S. Improvement of periodontal status by green tea catechin using a local delivery system: a clinical pilot study. J Periodontal Res 2002; 37: 433_8.
- Gadagi JS, Chava VK, Reddy VR. Green tea extract as a local drug therapy on periodontitis patients with diabetes mellitus: a randomized case-control study. J Indian Soc Periodontol 2013; 17: 198_203.
- Hattarki SA, Pushpa SP, Bhat K. Evaluation of the efficacy of green tea catechins as an adjunct to scaling and root planning in the management of chronic periodontitis using PCR analysis: a clinical and microbiological study. J Indian Soc Periodontol 2013; 17: 204_9.
- Chava VK, Vedula BD. Thermo-reversible green tea catechin gel for local application in chronic periodontitis: a 4-week clinical trial. J Periodontol 2013; 84: 1290_6.
- Kudva P, Tabasum ST, Shekhawat NK. Effect of green tea catechin, a local drug delivery system as an adjunct to scaling and root planing in chronic periodontitis patients: a clinicomicrobiological study. J Indian Soc Periodontol 2011; 15:39_45.
- Zhao L, La VD, Grenier D. Antibacterial, antiadherence, antiprotease, and anti-inflammatory activities of various tea extracts: potential benefits for periodontal diseases. J Med Food 2013; 16: 428_36.
- Makimura M, Hirasawa M, Kobayashi K, Indo J, Sakanaka S,Taguchi T, et al. Inhibitory effect of tea catechins on collagenaseactivity. J Periodontol 1993; 64: 630_6.
- Hosokawa Y, Hosokawa I, Shindo S, Ozaki K, Matsuo T.(-)-Epigallocatechin-3-gallate inhibits CC chemokine ligand 11production in human gingival fibroblasts. Cell Physiol Biochem. 2013; 31: 960_7.
- Okamoto M, Sugimoto A, Leung KP, Nakayama K,Kamaguchi A, Maeda N. Inhibitory effect of green tea catechins on cysteine proteinases in Porphyromonas gingivalis. Oral Microbiol Immunol 2004; 19: 118_200.
- Cai Y, Kurita-Ochiai T, Hashizume T, Yamamoto M. Green tea epigallocatechin-3-gallate attenuates Porphyromonas gingivalisinduced atherosclerosis. Pathog Dis 2013; 67: 76_83.
- Dhingra K, Vandana KL (2010) Prophylactic vaccination against periodontal disease: a systematic review of preclinical studies. J Periodontol 81, 1529-1546.
- Yokoyama K, Sugano N, Shimada T, Shofiqur RA, Ibrahim el-SM, Isoda R, Umeda K, Sa NV,Kodama Y, Ito K (2007) Effects of egg yolk antibody against Porphyromonas gingivalis gingipains in periodontitis patients. J Oral Sci 49, 201-206.
- Sugano N (2009) Adjunctive effects of anti-Porphyromonas gingivalis egg yolk antibodywith scaling and root planning: a randomized, placebo-controlled clinical trial. J Periodontol 80, 1901-1903.








